"comprehendere scire est"
Consejo Nacional para el Entendimiento Público de la Ciencia.
Consejo Nacional para el Entendimiento Público de la Ciencia.
Rosa Elena Arroyo-carmona + ; Carmen Córdova Lozano + ; Lucio Gutiérrez García + ; Aarón Pérez-benítez + Facultad De Ciencias Químicas Benemérita Universidad Autónoma De Puebla

I. Introducción.
Diariamente la naturaleza se viste de colores. Los animales y los vegetales los usan para alegrarnos la vida, condicionándonos de tal manera que a algunos colores artificiales los nombramos por su semejanza con los naturales: El verde limón, el azul marino, el violeta o el anaranjado, son tan sólo algunos ejemplos.

Pero la función de los colores no es puramente estético; muchos animales los usan para esconderse de sus depredadores, ¡Como el pez arena!, un pez plano que adquiere un color grisáceo y aletea para enterrarse en la arena del mar para esconderse. Otro ejemplo más es el de la falsa coralillo, una serpiente inofensiva que imita los colores de la coralillo para amedrentar a sus enemigos, lo cual, para su desgracia, ha provocado que sea una especie en vías de extinción, debido a que muchas personas las matan indiscriminadamente porque ignoran que se les puede diferenciar por la secuencia que presentan sus bandas de colores.
En contraste, muchas plantas utilizan los colores para atraer a los insectos y favorecer con ello la polinización.
Pero... ¿De dónde provienen los colores de las plantas? Pues muchos de los pigmentos que las colorean son las antocianinas,[1] las cuales pertenecen al grupo de compuestos químicos denominados flavonoides.[2] Por ejemplo, las cerezas, las moras, la col y la cebolla moradas, las hortensias, el maíz azul y muchas otras flores y frutas más contienen flavonoides.
Estos flavonoides se pueden extraer fácilmente usando disolventes polares como el agua o el etanol (entre otros), ya sea por maceración de la planta, flor o fruto, o por calentamiento a baño María o a ebullición.
Por ejemplo, el colorante de la col morada (brasica oleracea) se puede extraer calentando durante 5-10 minutos, una o dos hojas de la col en una taza con agua purificada. El colorante natural así obtenido es, por supuesto, totalmente comestible, por lo que se ha propuesto su uso como pigmento para medicamentos.
El colorante en cuestión se llama cianidina[3] (figura 1), y tiene propiedades químicas muy interesantes pues el color azul-violeta que presenta en medio neutro (pH = 7) cambia a colores que tienden hacia el rojo en medio ácido (pH = 1-6), y a colores que en medio básico tienden hacia el verde (pH = 8-12) y al amarillo (pH = 13-14) (figura 2).
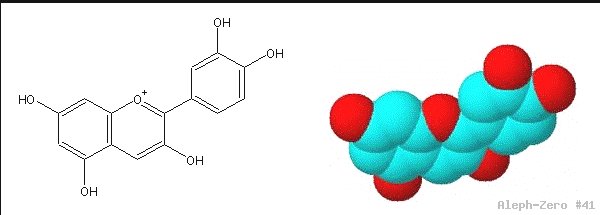
Figura 1. Fórmula estructural (izquierda) y un modelo de volumen (derecha) de la cianidina.
Estas propiedades se pueden comprobar rápidamente, mezclando el extracto de la col morada con dos tipos de sustancia de uso común en casa: a). Sustancias ácidas tales como vinagre, jugo de limón, etc., y b). Sustancias básicas tales como bicarbonato de sodio, melox, detergente lavatrastes, etc.
En caso de ser posible se pueden comparar los colores resultantes con los de tres testigos hechos a base de:
1). Agua destilada y el colorante;
2). Un ácido de concentración conocida y el colorante; y,
3). Una base de concentración conocida y el colorante.
Además de esa evidencia, se puede predecir el pH de una sustancia determinada, comparando el color resultante de la mezcla de la sustancia y el extracto de la col con el de la escala de colores de la figura 2.
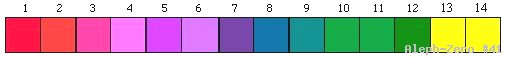
Figura 2. Escala de colores que toma el extracto de la col morada: en presencia de ácidos (1-6) y bases (8-14).
De manera más formal presentamos a continuación, la extracción del colorante de la col morada, tal y como la realizamos con nuestros estudiantes de licenciatura de la facultad de ciencias químicas de la BUAP; si bien, la práctica ha resultado tan sencilla y divertida para ellos, que nos ha motivado a realizarla en su forma más sencilla como un taller de divulgación de la ciencia en escuelas secundarias, primarias e incluso preescolares.
II. Obtención de un indicador de pH a partir de la col morada.
II.1. Objetivo general:
El estudiante comprenderá que en la naturaleza existen plantas de las que se pueden extraer productos químicos de utilidad alimenticia, química y farmacéutica.
II.2. Objetivos particulares:
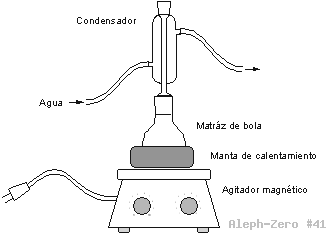
Figura 3. Equipo para la extracción del colorante de la col morada por reflujo de agua.
II.3. Parte experimental.
a). Materiales: | b). Reactivos: |
- 1 matraz de bola de 100 mL. | - HCl al 5 %. |
- 1 refrigerante. | - NaOH al 5 %. |
- 1 canasta de calentamiento. | - Agua destilada. |
- 10 tubos de ensaye. | - Sustancias comunes en casa: |
- 1 probeta de 5 mL. | · Bicarbonato de sodio, |
- 1 Varilla de vidrio. | · Sarricida, |
- 2 mangueras. | · Aspirina, |
- 1 bomba de recirculación. | · Refresco (preferentemente incoloro), |
- 1 espátula. | · Limpiador de estufas, etc. |
- 1 vaso de precipitados de 50 mL. |
|
Procedimiento:
Corte finamente media hoja de col morada y coloque los trocitos en el matraz de bola. Agregue agua destilada cuidando que el volumen total de agua más la col, no superen las 2/3 partes del matraz. Coloque el resto del equipo para realizar un reflujo. Caliente a reflujo durante 10 minutos o hasta obtener una solución azul-violeta. Deje que la solución se enfríe por si sola o con un baño de hielo o agua, hasta temperatura ambiente.
Decante la solución y coloque un mL de ella en cada uno de los tubos de ensaye. Numere los tubos del 1 al diez. En el tubo uno agregue gota a gota HCl al 5 % hasta 1 mL o hasta que ya no se observe ningún cambio de color. Al tubo dos agregue gota a gota NaOH al 5 % hasta 1 mL o hasta que se ya no se observe ningún cambio de color. Al tubo tres agregue 1 mL de agua destilada.
En los tubos 4-10 agregue respectivamente, pequeñas porciones de las sustancias a probar, por ejemplo, un cuarto de aspirina, hasta un mL de sarricida, un trocito de tomate o jitomate, algunas gotas de limón, refresco, cal, etc.
Para determinar si la sustancia en cuestión es ácida, básica o neutra, compare la coloración resultante con la de los tubos 1-3 (testigos). Adicionalmente, si cuenta con una presentación a colores de la figura 2, proporcione el valor aproximado de pH obtenido.
Cuestionario (Preguntas pre-lab = 1-4. Preguntas post-lab = 5-9):
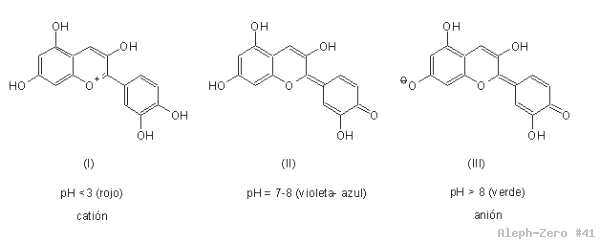
Figura 4. Estructuras de la cianidina en función del pH.[4]
Conclusión.
Si bien la parte experimental ha sido preparada para el desarrollo de las habilidades prácticas de los estudiantes de preparatoria o de licenciatura que cuenten con el material de vidrio necesario para llevar a cabo el reflujo de la col morada en agua, el procedimiento puede adaptarse fácilmente a otros niveles escolares o a otra disponibilidad de materiales de laboratorio. Por ejemplo, a falta de material de vidrio se puede hervir la col en cualquier recipiente, y una vez que se enfríe el extracto, se pueden realizar las pruebas de pH en vasitos de plástico transparentes.
Asimismo, simplemente se puede utilizar agua caliente proveniente de una cafetera, un horno de microondas o una estación de agua para beber, la cual se deposita en vasos de unicel conteniendo los trocitos de col. Si aún con todas estas facilidades no puede disponer de agua caliente o lo considera peligroso para sus alumnos, entonces se puede dejar macerar la col en agua o etanol un día antes de realizar la práctica.
El extracto también puede prepararse moliendo la col en una licuadora con un poco de agua y pasando la mezcla por una coladera. Si su objetivo es que los estudiantes aprendan a realizar operaciones de laboratorio empleando materiales de bajo costo, entonces el filtrado se puede realizar con una servilleta de papel y la parte cónica de una botella recortada a manera de embudo.
Como alternativa a la col morada se pueden emplear otro tipo de colorantes naturales provenientes de flores[5] o de frutos, pero debe tener en consideración que el rango de vire del indicador puede ser diferente. De la misma manera, los resultados pueden variar al utilizar agua purificada o agua de la llave, cuyo contenido de sales produce resultados diferentes a los que se obtienen al usar agua destilada.
Con un poco de paciencia y mucho entusiasmo, nosotros logramos realizar esta práctica con un grupo de quince estudiantes de nivel preescolar.

Cuentos y ciencia ficción. José Luis Ramírez + .
Divulgadores. Alfonso Balandra Antelis + Facultad De Ciencias De La Computación Benemérita Universidad Autónoma De Puebla.
Divulgadores. Jessica Flood Garibay + Licenciatura En Química Departamento De Química Y Biología Universidad De Las Américas, Puebla.
Divulgadores. Hector Javier Ibarra Medel + Licenciatura En Física Departamento De Física Y Matemáticas Universidad De Las Américas, Puebla.
Divulgadores. Susana H. Reyes + 5° Semestre En Ciencias Farmacéuticas Departamento De Química Y Biología Universidad De Las Américas, Puebla.
Divulgadores. Adolfo Córdova Ortiz + Asociación Estudiantil "helecho" Universidad De Las Américas, Puebla.
Divulgadores. Alfredo Osorio Santiago + .
Divulgadores. Biol. Rodolfo Carvajal Mateos + Control De Calidad Janssen-cilag De México.
Divulgadores. Phd Adolfo Vásquez Rocca + Universidad Católica De Valparaíso – Universidad Complutense De Madrid.
Divulgadores. Rosa Elena Arroyo-carmona + ; Carmen Córdova Lozano + ; Lucio Gutiérrez García + ; Aarón Pérez-benítez + Facultad De Ciencias Químicas Benemérita Universidad Autónoma De Puebla.
Editorial. Miguel Ángel Méndez-rojas + Departamento De Química Y Biología Universidad De Las Américas, Puebla.
Editorial. Gabriel Yensen Bazán Walker + Alephzero.
Educadores. M. En C. Gustavo López Badilla + Escuela De Ingeniería, Cetys-mexicali.
Educadores. Marisa Avogadro + Cátedra De Comunicación Estratégica Y Cibercultura, Itesm-cem.
Investigación. Fabio Cupul Magaña + Universidad De Guadalajara, Puerto Vallarta.
Investigación. Victor Landa-jaime + ; M Saucedo-lozano + ; D Godínez Domínguez + Departamento De Estudios Para El Desarrollo Sustentable De Zonas Costeras Centro Universitario De La Costa Sur, Universidad De Guadalajara.
Investigación. Ramiro Flores Vargas + Centro Universitario De La Costa Sur, Departamento De Estudios Para El Desarrollo Sustentable De Zonas Costeras ; María Del Carmen Navarro-rodríguez + ; Luis Fernando González Guevara + ; María Elena González Ruelas + Centro Universitario De La Costa, Campus Vallarta, Departamento De Ciencias Universidad De Guadalajara, Jalisco, México.