"comprehendere scire est"
Consejo Nacional para el Entendimiento Público de la Ciencia.
Consejo Nacional para el Entendimiento Público de la Ciencia.
Julia Pérez Iglesias + Dpto. Química Analítica, E.U.Politécnica; Hervilia Seco Lago + Universidad de A Coruña Ctra
En este artículo se proponen métodos experimentales de determinaciones volumétricas en diferentes tipos de reacciones: ácido-base, redox, formación de complejos y precipitación. El objetivo general es dominar la técnica volumétrica en el laboratorio, así como saber aplicar un tratamiento correcto a los datos obtenidos. Para ello, se proponen cuatro prácticas de dificultad creciente.
INTRODUCCIÓN
Un análisis volumétrico es cualquier procedimiento basado en la medida del volumen de reactivo necesario para que reaccione con el analito.
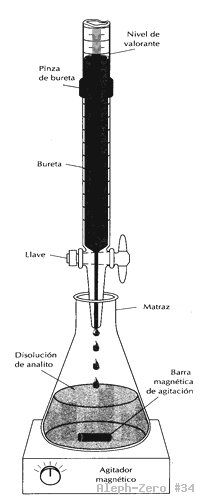
En una valoración al analito se le añaden incrementos de la disolución del reactivo (el valorante) hasta que la reacción se completa. A partir de la cantidad de valorante gastada, se puede gastar la cantidad de analito que debía haber en la muestra. Por lo general, el valorante se añade desde una bureta (figura 1).
Los principales requisitos de una reacción útil para que sirva de base para una valoración es que tenga una constante de equilibrio grande y que transcurra rápidamente. Es decir, cada nuevo incremento de valorante debe consumirse completa y rápidamente por el analito hasta su total agotamiento.
Las valoraciones más comunes están basadas en reacciones: A) ácido-base, B) oxidación- reducción, C) formación de complejos y D) precipitación.
El punto de equivalencia es el punto en el que la cantidad de valorante añadida es exactamente la necesaria para que reaccione estequiométricamente con el analito.
Por ejemplo, 5 moles de ácido oxálico reaccionan con 2 moles de permanganato en disolución ácida caliente:
HO – CO – CO – OH + 2 MnO4- + 6 H+ ¾¾® 10 CO2 + 2 Mn2+ + 8 H2O
analito valorante
(incoloro) (púrpura) (incoloro) (incoloro)
El punto de equivalencia es el resultado ideal (teórico) que se busca en una valoración.
Lo que en realidad medimos es el punto final, que se observa con un brusco cambio de una propiedad física de la disolución. En el ejemplo, un punto final adecuado es la aparición brusca de color púrpura de permanganato en el matraz. Hasta el punto de equivalencia, todo el permanganato es consumido por el ácido oxálico, y la disolución permanece incolora. Después del punto de equivalencia, el MnO4- que ya no reacciona se acumula hasta que hay bastante para poder verse. La primera traza de color púrpura señala el punto final. Cuanta mayor sensibilidad tenga la vista, más cerca del punto de equivalencia tendrá el punto final medido.
Entre los métodos para determinar el momento en que se ha consumido el analito, se pueden citar:
- detectar un cambio brusco de voltaje o de corriente entre un par de electrodos,
- observar un cambio de color del indicador,
- seguimiento de la absorción de la luz.
Un indicador es un compuesto con una propiedad física (normalmente color) que cambia bruscamente cerca del punto de equivalencia. El cambio lo causa la desaparición del analito o la aparición del exceso de valorante.
La diferencia entre el punto final y el punto de equivalencia es el error de valoración, que prácticamente es inevitable. Aunque es posible estimar el error de la valoración con una valoración en blanco, en la cual se lleva a cabo el mismo procedimiento pero sin el analito. Por ejemplo, una disolución que no contiene ácido oxálico podría valorarse con permanganato potásico para ver cuanto reactivo se necesita para observar el color púrpura. Este volumen del MnO4- se resta del volumen observado en la valoración analítica.
La validez de un resultado analítico depende de que se sepa la cantidad de los reactivos usados. La concentración del valorante se puede conocer de dos formas:
- Patrón Primario. Si el valorante fue preparado disolviendo una cantidad de reactivo puro en un volumen conocido de disolución. Un patrón primario ha de tener una pureza del 99,9 % o más, no debe descomponerse en condiciones normales de almacenamiento y ha de ser estable al calor y al vacío para poder eliminar la humedad adsorbida de la atmósfera.
- Disolución Estándar. Se utiliza una disolución que tiene aproximadamente la concentración deseada y se valora con un patrón primario (1).
A) VOLUMETRÍA DE NEUTRALIZACIÓN (ÁCIDO-BASE)
La volumetría de neutralización es una técnica analítica que permite calcular la concentración de una base (ácido) disueltos, conocido el volumen de una disolución patrón de un ácido (o base) conocida, necesaria para su neutralización, después de haberle añadido un indicador.
La ecuación química correspondiente a este tipo de volumetría será:
ácido + base ¾¾® sal + agua
Objetivo: Determinar la concentración de una disolución de NaOH empleando HCl de concentración conocida (2).
Muestra y reactivos:
Disolución de NaOH (hidróxido de sodio) de concentración desconocida
Disolución de HCl (ácido clorhídico) 0,1 M
Disolución alcohólica de fenolftaleína
Procedimiento y cálculos: Conocido el volumen de HCl 0,1 M consumido en la valoración, halle la concentración de la disolución de NaOH de la muestra, expresada en molaridad.
Procedimiento:
a) Llene la bureta con disolución de HCl 0,1 M y abra la llave un instante con objeto de quitar el aire de su parte inferior y enrase la bureta.
b) Extraiga 10 mL de la disolución de NaOH que se va a valorar, con la pipeta y deposítelos en el matraz erlenmeyer.
c) Añada una o dos gotas de fenolftaleína a la base, que adquirirá una coloración rosada y si es necesario añada agua destilada con el frasco lavador hasta una cantidad tal que permita un fácil manejo del líquido.
d) Deje caer gota a gota la disolución de la bureta (HCl) sobre el erlenmeyer que contiene el NaOH, agitando con la mano o agitador magnético, hasta que desaparezca el color (figura 1).
e) Anote el volumen de HCl gastado y repita la valoración hasta obtener al menos 4 valores concordantes de volumen de disolución de HCl gastado.
f) Calcule el valor medio de los resultados obtenidos.
Cálculos: Sabiendo que se han consumido un volumen V mL de HCl, y que éste reacciona con el NaOH según la ecuación química siguiente:
HCl + NaOH ¾¾® NaCl + H2O
· Calcule la molaridad de la disolución problema.
Las volumetrías basadas en una reacción de oxidación-reducción entre un valorante o reactivo y un problema tienen un campo de aplicación muy extenso entre las sustancias inorgánicas y orgánicas.
A parte de muchos analitos comunes en química, biología y en ciencias ambientales y de materiales que se pueden determinar por valoraciones redox, también se pueden determinar estados de oxidación exóticos de elementos en materiales no comunes, como los superconductores y materiales láser.
Objetivo: Conocer el contenido en hipocloritos en una muestra mediante una valoración yodométrica (3).
Muestra y reactivos:
Muestra de lejía comercial
Disolución de tiosulfato sódico, Na2S2O3, 0,100M (trioxodisulfato(II) de sodio)
Disolucción de yoduro potásico, KI, 1%
Ácido acético, CH3COOH, comercial
Engrudo de almidón
Procedimiento y cálculos: El cloro activo puede determinarse yodometricamente agregando yoduro potásico en medio ácido:
NaClO + KI ¾ H+ ¾® Cl- + I2
La cantidad de yodo liberado equivale a la de cloro activo, también puede escribirse:
Cl2 + 2I- ¾¾® I2 + 2Cl-
Esta determinación del contenido de hipoclorito HClO (cloro activo) en una muestra se lleva a cabo en dos etapas:
1ªetapa: se hace reaccionar el hipoclorito con yoduro potásico en medio ácido y tiene lugar una reacción de oxidación – reducción.
NaClO + KI ¾ CH3COOH ¾® Cl- + I2
Oxidación 2I- ¾® I2 + 2e-
Reducción ClO- + 2H+ + 2e- ¾® Cl- + H2O
¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾
Ecuación iónica 2I- + ClO- + 2H+ ¾® I2 + Cl- + H2O
Ecuación molecular 2KI + NaClO + 2 CH3COOH ¾® I2 + NaCl + H2O + 2CH3COOK
2ª etapa: el yodo obtenido se valora con tiosulfato sódico en medio ácido. Tiene lugar entre ambos una reacción redox:
I2 + Na2S2O3 ¾ CH3COOH ¾® Na2S4O6 + I-
Oxidación S2O32- ¾® 2S4O62- + 2e-
Reducción I2 + 2e- ¾® 2I-
¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾
Ecuación iónica I2 + S2O32- ¾® 2S4O62- + 2I-
Ecuación molecular I2 + 2 Na2S2O3 ¾® 2NaI + Na2S4O6
Procedimiento:
a) Se llena la bureta con la disolución de tiosulfato sódico, Na2S2O3, 0,100M (trioxodisulfato(II) de sodio), se eliminan las burbujas y se enrasa.
b) Una alícuota de la muestra se pone en el vaso de precipitados y se miden 2 mL de la muestra problema, utilizando la pipeta y el auxiliar de pipeteado.
c) Se introduce en el matraz erlenmeyer, se añade agua destilada hasta un volumen total de aproximadamente 100 mL
d) Utilizando la probeta, se añaden primero 20 mL de la disolución de yoduro potásico, KI 1% y a continuación 5 mL de ácido acético (es necesario lavar la probeta entre las dos medidas). La disolución tomará un color pardo rojizo por el yodo formado.
e) Se inicia la valoración añadiendo la disolución de tiosulfato sódico hasta que el color pardo pase a un tono amarillento, en ese momento, se adicionan unas gotas de engrudo de almidón, que darán a la disolución un color azul intenso, continúa la valoración hasta desaparición del color azul.
f) Repita el proceso un mínimo de 10 veces.
Este tipo de volumetrías se basa en la reacción de complejación de los cationes metálicos en disolución acuosa con un quelón (o complexona) a pH conveniente y un indicador adecuado.
El quelón y el catión metálico se combinan en la relación molar 1:1, formando un complejo de coordinación soluble, incoloro y muy estable.
La complexona que utilizaremos es el ácido etilendiamino-N,N,N',N'-tetraacético (AEDT), como sal disódica, cuyo anión diprótico sule representarse con el símbolo YH22-.
YH22- + Me2+ Û YMe2- + 2 H+
Esta reacción general indica que cuanto más pequeña sea la constante de formación del complejo metal – AEDT, más alto debe ser el pH de la disolución para que pueda formarse el complejo.
Los indicadores utilizados en este tipo de valoraciones son, en su mayor parte, colorantes azoicos y derivados del trifenilmetano, que forman complejos fuertemente coloreados con los iones metálicos, siendo esta coloración diferente de la propia del indicador libre en disolución acuosa pura.
Los complejos ion metálico-indicador (Me – Ind) deben ser estables, pero menos que los correspondientes complejos metal – AEDT (Me – AEDT), con objeto de que pueda observarse un cambio de color notable por desplazamiento del ligando del complejo metal-indicador, según el equilibrio:
Me – Ind + AEDT Û Me – AEDT + Ind. libre
Objetivo: Determinar la riqueza de un hilo de cobre, mediante volumetría (4).
Muestra y reactivos:
Hilo de cobre
Ácido nítrico, HNO3 25% (trioxonitrato (V) de hidrógeno)
Nitrito sódico, NaNO2 (dioxonitrato (III) de sodio)
Hidróxido amónico (NH4OH) 1 M
Disolución AEDT 0,01 M (ácido etilendiaminotetraacético)
Mezcla homogénea murexida / NaCl (1/100)
Procedimiento y cálculos: Halle experimentalmente la riqueza en cobre de la muestra problema de hilo de cobre (para ello determine experimentalmente, tal como se indica en el procedimiento, el contenido en cobre de la muestra problema de hilo de cobre).
Procedimiento:
a) Se pesan 0,20 gramos de la muestra de hilo de cobre en un vaso de precipitados. Para disolver la muestra se añaden 10 ml de ácido nítrico, HNO3 25% y para acelerar este proceso, en la campana de extracción se añade una punta de espátula de NaNO2.
La reacción de disolución del cobre es:
3 Cu(s) + 8 NO3- (ac) + 8 H+ (ac) ¾¾® 3 Cu2+ (ac) + 6 NO3- (ac) + 2 NO(g) + H2O (l)
3 Cu(s) + 8 HNO3 (ac) ¾¾® 3 Cu(NO3)2 (ac) + 2 NO (g) + 4 H2O (l)
b) Cuando la muestra esté completamente disuelta, se transfiere su contenido a un matraz aforado de 100 mL y se completa el volumen hasta el enrase con agua destilada (si la muestra está turbia es necesario filtrarla previamente).
c) Se toma una alícuota de 5 mL de la disolución de cobre por medio de la pipeta y se transfiere a un erlenmeyer, se incorporan 40 mL de agua destilada, y se añaden unas gotas de disolución de hidróxido amónico 1M (unas 10 gotas).
d) Como indicador se adiciona una punta de espátula de murexida.
e) Se valora inmediatamente con la disolución patrón de AEDT 0,01 M hasta viraje del amarillo al púrpura. Anote el volumen de disolución de AEDT consumido.
f) Se lava el erlenmeyer y se enjuaga con agua destilada, repitiendo el procedimiento anteriormente indicado hasta obtener al menos, cuatro valores concordantes de volumen de disolución de AEDT gastado.
Cálculos: Sabiendo que inicialmente se disponía de una muestra de hilo de cobre de 0,20 g que se ha disuelto en un matraz aforado de 100 mL, que de la disolución obtenida se han tomado 5 mL, en los cuales se ha determinado el contenido en Cu2+ mediante valoración con AEDT 1,00 ´ 10-2 M, consumiéndose de esta disolución un volumen V mL (valor medio de las tres determinaciones), y teniendo en cuenta que la reacción que transcurre es la siguiente:
YH22- (ac) + Cu2+ (ac) ¾¾® YCu2- (ac) + 2 H+ (ac)
Calcule:
· El número de moles y los gramos de Cu2+ presentes en los 5 mL de la disolución de cobre.
· El número de moles y los gramos de Cu2+ presentes en los 100 mL de la disolución de cobre.
· La riqueza de la muestra del hilo de cobre.
Cuando se mezclan disoluciones de dos electrolitos diferentes puede observarse, a veces, que se produce un sólido que se separa de la disolución. Este sólido es un precipitado.
Las reacciones de precipitación pueden ser usadas para determinarla concentración de ciertas especies de una disolución. Un procedimiento frecuente es el denominado valoraciones de precipitación.
Es importante reconocer que no todas las reacciones de precipitación son aplicables a análisis titulométricos, pues muchas son demasiado lentas y como resultado se requiere mucho tiempo para que se completen, por lo cual, el punto final de la titulación puede ser incierto.
Un segundo inconveniente al emplear las reacciones de precipitación es que tienden a no ser altamente específicas. Las impurezas con propiedades químicas similares también coprecipitan y, en consecuencia, los resultados se elevan.
Un tercer inconveniente es que los indicadores colorimétricos necsarios son algo complicados: requieren de condiciones de pH y fuerza iónica cuidadosamente controladas para funcionar en forma moderada.
Objetivo: Determinar el contenido en cloruros en una muestra de agua mediante un método volumétrico y estimar, mediante parámetros matemáticos básicos, la precisión (reproducibilidad) de la medida efectuada (5).
Muestra de aguas de acuíferos naturales
Cromato potásico (K2CrO4) al 10%
Nitrato de plata (AgNO3) 4,791 g/L
Procedimiento y cálculos:
El método propuesto por Mohr para la determinación de cloruros es una volumetría de precipitación que consiste en una precipitación fraccionada de los cloruros presentes en el agua en forma de cloruro de plata,
Cl- (ac) + Ag+ (ac) ¾¾® AgCl (s)
Utilizando un cromato alcalino como indicador, concretamente el K2CrO4 que inicialmente proporciona un color amarillento a la disolución y que pone de manifiesto el punto final de la valoración, al producirse un cambio de color, de amarillo a rojo, consecuencia de la reacción entre los iones Ag+ y los iones CrO42- que forman un segundo precipitado de cromato de plata.
CrO42- (ac) + 2 Ag+ (ac) ¾¾® Ag2CrO4 (s) (rojo)
Procedimiento:
a) Se miden 100 mL de agua a analizar con ayuda de una probeta, se pasan a uno de los matraces erlenmeyer y se le añaden 10 gotas del indicador cromato potásico al 10%.
b) Se prepara una segunda muestra de agua como se indica en el apartado anterior y se añaden igualmente 10 gotas del indicador cromato potásico al 10%.
c) Se llena y enrasa la bureta con disolución patrón de AgNO3 ( de concentración 4,791 g/L) usando las llaves de que está provista.
d) Se valora la primera muestra de agua con la disolución de nitrato de plata hasta que el color varíe del amarillo al pardo rojizo débil persistente. Durante dicha valoración se mantiene la segunda muestra de agua como referencia para observar mejor el cambio cromático que se produce en la misma.
Cálculos: A partir de los datos obtenidos calcule:
En resumen, los requisitos para ensayos volumétricos son los siguientes:

Convocatoria. Redacción.
Divulgadores. Marisa Avogadro + .
Divulgadores. Mtro. Jorge David Cortés Moreno ; Ramón Domínguez Sánchez;.
Editorial. Gabriel Merino + Technische Universität Dresden Institut für Physikalische Chemie und Elektrochemie .
Investigación. Julia Pérez Iglesias + Dpto. Química Analítica, E.U.Politécnica; Hervilia Seco Lago + Universidad de A Coruña Ctra.
Presentacion. Gabriel Yensen Bazan W..
Qwerty. José L. Ramírez.
Testimonio. Gabriela Espinosa + Institutt for Teknisk Kybernetikk Norges Teknisk-Naturvitenskapelige Universitet.
Testimonio. Liliana Quintanar Vera + Department of Chemistry Stanford University.
Testimonio. Miguel Ángel Méndez Rojas + UDLAP; Carlos Amezcua .
Testimonio. Alán Aspuru-Guzik .
Testimonio. Javier Vela-Becerra + .
Testimonio. Pavel Albores Barajas + University of Strathclyde in Glasgow.
Testimonio. Luis Diaz-Santana + Cambridge, Inglaterra.
Testimonio. .
Testimonio. Juan Carlos Gálvez Ruiz.
Testimonio. Alejandro Espinosa Calderón + .